Анод — Википедия




Ано́д (др.-греч. ἄνοδος — движение вверх) — электрод некоторого прибора, в который втекает электрический ток (в его конвенциональном понимании как поток положительных зарядов), в противоположность катоду из которого он вытекает.
При процессах электролиза (получение элементов из солевых растворов и расплавов под действием постоянного электрического тока), анод — электрически положительный полюс, на нём происходят окислительно-восстановительные реакции (окисление), результатом которых, в определённых условиях, может быть разрушение (растворение) анода, что используется, к примеру, при электрорафинировании металлов.
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде. Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Кроме принудительной организации полезных электрохимических процессов, аноды применяются и для защиты от последствий нежелательных, побочных электрохимических процессов.
Анод в вакуумных электронных приборах[править | править код]
В вакуумных электронных приборах анод — электрод, который притягивает к себе летящие электроны, испущенные катодом. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
Электрод полупроводникового прибора (диода, тиристора), подключённый к положительному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют
В литературе встречается различное обозначение знака анода — «+» или «−», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление[1]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод.
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора[2][3].
В электротехнике анод — положительный электрод, ток течёт от анода к катоду, электроны, соответственно, наоборот.
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Катод — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 февраля 2018; проверки требуют 9 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 25 февраля 2018; проверки требуют 9 правок. Схема гальванического элемента Даниэля-Якоби
Схема гальванического элемента Даниэля-ЯкобиКатод (от греч. κάθοδος «ход вниз; нисхождение») — электрод некоторого прибора, из которого вытекает электрический ток (в его конвенциональном понимании как поток положительных зарядов), в противоположность аноду в который он втекает.
Катод в электрохимии и цветной металлургии[править | править код]

В электрохимии катод — электрод, на котором происходят реакции восстановления. Например, при электролитическом рафинировании металлов (меди, никеля и пр.) на катоде осаждается очищенный металл. Получаемый металл также именуется катодом (катод медный[1], катод никелевый, катод цинковый и т.п.) и используется для последующего изготовления металлической продукции (проволоки, фольги, порошка, изделий и пр.). Для сдирания готового катода с постоянной катодной основы используются катодосдирочные машины.
Катод в вакуумных электронных приборах[править | править код]
В вакуумных электронных приборах катод — электрод, который является источником свободных электронов, обычно вследствие термоэлектронной эмиссии. В электронно-лучевых приборах катод входит в состав электронной пушки. Для облегчения электронной эмиссии как правило, делается с нанесением металлов с малой работой выхода электрона и дополнительно подогревается. Различают катоды прямого накала, где нить накала непосредственно является источником электронов, и косвенного, где катод подогревается через керамический изолятор.
Электрод полупроводникового прибора (диода, тиристора), подключенный к отрицательному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют катодом, подключённый к положительному полюсу — анодом.
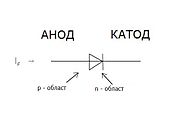
В литературе встречается различное обозначение знака катода — «−» или «+», что определяется, в частности, особенностями рассматриваемых процессов. В электрохимии принято считать, что «−» катод — электрод, на котором происходит процесс восстановления, а «+» анод — тот, где протекает процесс окисления[2][3]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод. В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод. Так, на приведённой иллюстрации изображён обозначенный знаком «-» катод гальванического элемента, на котором происходит восстановление меди. В соответствии с таким толкованием, для аккумулятора знак анода и катода меняется в зависимости от направления протекания тока. [3][4][5].
В электротехнике за направление тока принято считать направление движения положительных зарядов, отрицательный электрод «−» (Zn) — катод, положительный «+» (Cu) — анод, ток течёт от анода к катоду, электроны, соответственно, наоборот, от «−» (Zn) к «+» (Cu).
- ↑ ГОСТ 546-2001 Катоды медные. Технические условия
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ 1 2 Лукомский Ю. Я., Гамбург Ю. Д. Физико-химические основы электрохимии: Учебник. — Долгопрудный : Издательский Дом «Интеллект», 2008. — С. 19 — ISBN 978-5-91559-007-5
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
ru.wikipedia.org
Катодный и анодный процессы
Электрохимия – это раздел химии, который изучает процессы, протекающие в расплавах или растворах электролитов при прохождении через них постоянного электрического тока.
Данные процессы сопровождаются окислительно-восстановительными реакциями.
Собственно электрохимические превращения называются электролизом.
Любой процесс электролиза протекает с применением электродов – положительно или отрицательно заряженных материалов, которые участвуют в переносе электронов на границе двух фаз: расплав или раствор электролита – материал электрода.
Электрохимические процессы исследуют в т.н. электрохимических ячейках, состоящих из сосуда с расплавом или раствором электролита и помещёнными в него электродами, через которые пропускают постоянный электрический ток
Электроды могут состоять из различных материалов. Нерастворимые электроды, как правило, состоят из графита, золота, платины а растворимые – из любых металлов (кроме щелочных).
Как известно, процесс диссоциации электролита сопровождается распадом его на катионы (положительно заряженные частицы) и анионы (отрицательно заряженные частицы).
Например, в случае диссоциации хлорида натрия, это можно изобразить схемой:
NaCl ↔ Na+ + Cl—
Если расплав данного электролита поместить в электрохимическую ячейку и пропустить через него электрический ток, то на катоде будут восстанавливаться катионы, а на аноде будут окисляться анионы.
Таким образом, в совокупности, процесс электролиза представляет собой катодный и анодный процессы или окислительно-восстановительные реакции.
Продукты электролиза зависят прежде всего от того, в каком виде находится электролит (расплав или раствор), от материала электрода (инертный или растворимый) и от положения металла, входящего в состав соли, в ряду напряжения. В общем виде, всё это может быть сведено в следующие правила:
1) Катион электролита расположен в ряду напряжения до алюминия (включительно), то на катоде идёт процесс восстановления воды – выделяется водород.
2) Катион металла находится в ряду напряжения между алюминием и водородом, то на катоде одновременно восстанавливаются ионы металла и молекулы воды.
3) Катион металла расположен в ряду напряжения после водорода, то на катоде восстанавливается металл.
4) В растворе содержатся катионы разных металлов, то сначала восстанавливаются катионы металла, стоящего в ряду напряжения правее.
5) При растворимом аноде окисляется металл анода, независимо от вида катиона в электролите и природу аниона.
6) При нерастворимом аноде
— а) в случае электролиза раcтворов бескислородных кислот ( кроме фторидов) на аноде идёт процесс окисления аниона.
— б) в случае электролиза растворов солей кислородсодержащих кислот и фторидов на аноде идёт процесс окисления воды (выделяется кислород). Анионы не окисляются.
— в) анионы по их способности окисляться располагаются в следующем порядке:
Электролиз расплавов электролитов.
Как правило, электролиз данного вида осуществляется для соединений с ионным типом связей (соли, щёлочи).
При электролизе расплава гидроксида калия происходят следующие процессы:
Электролиз растворов электролитов.
В растворах электролитов, помимо катионов и анионов, присутствуют молекулы воды. При электролизе воды происходят следующие процессы:
Рассмотрим электролиз хлорида натрия в случае нерастворимого и растворимого анода.
а) Анод нерастворимый.
В растворе протекает процесс электролитической диссоциации:
NaCl = Na+ + Cl—
на катоде (-) ионы натрия не восстанавливаются, остаются в растворе: 2H2O + 2ē → h3 + 2OH—
на аноде (+): 2Cl— — 2ē → Cl2
Суммарное ионное уравнение:
2H2O + 2Cl— = H2 + Cl2 + 2OH—
Учитывая присутствие ионов натрия в растворе, составим молекулярное уравнение:
2NaCl + 2H2O → H2 + Cl2 + 2NaCl
б) Анод растворимый (например, медный).
Если анод растворимый, то металл анода будет окисляться:
Cuо — 2ē → Cu2+
Катионы меди в ряду напряжений стоят после водорода, поэтому они будут восстанавливаться на катоде.
на катоде (-): Cu2+ + 2ē → Cuо
на аноде (+): Cuо — 2ē → Cu2+
При этом концентрация хлорида натрия в растворе не меняется.
Если Вам нужна помощь по химии, записывайтесь в расписании на сайте ко мне на занятия.
С уважением, Ваш Владимир Смирнов.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Аноды в химии что такое. Что такое анод и катод — простое объяснение
Анод в электрохимии
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде . Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Анод в вакуумных электронных приборах
Знак анода и катода
В литературе встречается различное обозначение знака анода — «+» или «-», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление . При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В электротехнике анод — положительный электрод, ток течет от анода к катоду, электроны , соответственно, наоборот.
См. также
- Мнемонические правила запоминания знака анода
Литература
Ссылки
- // Энциклопедический словарь Брокгауза и Ефрона : В 86 томах (82 т. и 4 доп.). — СПб. , 1890-1907.
- Рекомендации ИЮПАК по выбору знака для величин анодного и катодного токов
Wikimedia Foundation . 2010 .
Синонимы :Смотреть что такое «Анод» в других словарях:
— (греч. anodos восходящая дорога). В гальваническом элементе, одна из двух пластинок или проволок, по которой вступает или выходит из жидкости электрический ток. Противоположность катоду. Словарь иностранных слов, вошедших в состав русского языка … Словарь иностранных слов русского языка
анод — а, м. anode f., англ. anode <гр. anodos путь вверх, восхождение. физ. Положительно заряженный электрод. В действии таких приборов, как гальваническая батарея, полярности нет и быть не может.. <положительный и отрицательный полюс..… … Исторический словарь галлицизмов русского языка
Отрицательный электрод Словарь русских синонимов. анод сущ., кол во синонимов: 1 электрод (10) Словарь синонимов ASIS. В.Н. Тришин … Словарь синонимов
анод — электровакуумного прибора; анод; отрасл. коллектор Электрод, основным назначением которого обычно является прием основного потока электронов при электрическом разряде … Политехнический терминологический толковый словарь
анод — (устройства) электрод, через который электрический ток входит в среду, имеющую удельную проводимость, отличную от удельной проводимости анода [СТ МЭК50(151) 78] анод EN anode electrode capable of emitting positive charge… … Справочник технического переводчика
— (от греческого anodos движение вверх, восхождение), электрод электронного или электротехнического прибора (например, электронной лампы, гальванического элемента, электролитической ванны), характеризующийся тем, что движение электронов во внешней… … Современная энциклопедия Толковый словарь Ожегова
— (от греч. anodos движение вверх), 1) электрод электронного или ионного прибора, соединяемый с положит. полюсом источника. 2) Положит. электрод источника электрич. тока (гальванич. элемента, аккумулятора). 3) Положит. электрод электрич. дуги.… … Физическая энциклопедия
Определить, какой из электродов является анодом, а какой – катодом, на 1-й взор кажется легко. Принято считать, что анод имеет негативный заряд, катод – правильный. Но на практике могут появиться путаницы в определении.
Инструкция
1. Анод – электрод, на котором протекает реакция окисления. А электрод, на котором происходит поправление, именуется катодом.
2. Возьмите для примера гальванический элемент Якоби-Даниэля. Он состоит из цинкового электрода, опущенного в раствор сульфата цинка, и медного электрода, находящегося в растворе сульфата меди. Растворы соприкасаются между собой, но не смешиваются – для этого между ними предусмотрена пористая перегородка.

innovakon.ru
Электролиз — Википедия

Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Электролиз является одним из лучших способов золочения или покрытия металла медью, золотом.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный[1]. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза.


Электролиз широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия , меди, водорода, диоксида марганца[2], пероксида водорода. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
m=k⋅q=k⋅I⋅t{\displaystyle m=k\cdot q=k\cdot I\cdot t}, если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности k{\displaystyle k} называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея[править | править код]
- m=miNi{\displaystyle m=m_{i}N_{i}} (1)
- mi=M/Na{\displaystyle m_{i}=M/N_{a}} (2)
- Ni=Δqqi{\displaystyle N_{i}={\frac {\Delta q}{q_{i}}}} (3)
- Δq=IΔt{\displaystyle \Delta q=I\Delta t} (4)
- qi=ez{\displaystyle q_{i}=ez}, (5)
- где z — валентность атома (иона) вещества,
- e — заряд электрона
- Подставляя (2)-(5) в (1), получим
- m=MzeNAIΔt{\displaystyle m={\frac {M}{zeN_{A}}}I\Delta t}
- m=MzFIΔt{\displaystyle m={\frac {M}{zF}}I\Delta t},
где F=eNA{\displaystyle F=eN_{A}} — постоянная Фарадея.
- k=MFz{\displaystyle k={\frac {M}{Fz}}}
- m=kIΔt{\displaystyle m=kI\Delta t}
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
Химическим эквивалентом иона называется отношение молярной массы A{\displaystyle A} иона к его валентности z{\displaystyle z}. Поэтому электрохимический эквивалент
- k = 1F⋅Az{\displaystyle k\ =\ {1 \over F}\cdot {A \over z}},
где F{\displaystyle F} — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
- m=M⋅I⋅Δtn⋅F{\displaystyle m={\frac {M{\cdot }I{\cdot }{\Delta }t}{n{\cdot }F}}},
- где M{\displaystyle M} — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль
- I{\displaystyle I} — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А
- Δt{\displaystyle {\Delta }t} — время, в течение которого проводился электролиз, с
- F{\displaystyle F} — постоянная Фарадея, Кл·моль−1
- n{\displaystyle n} — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного)
- Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы активных металлов | Катионы менее активных металлов | Катионы неактивных металлов |
|---|---|---|
| Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ | Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ | Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются, и восстанавливается только металл |
| Анионы кислородсодержащих кислот и фторид-ион | Гидроксид-ионы; анионы бескислородных кислот (кроме F−) |
|---|---|
| PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F− | OH−, Cl−, Br−, I−, S2− |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |
Расплавы[править | править код]
Активные металлы, менее активные металлы и неактивные металлы в расплавах ведут себя одинаково.
Растворы[править | править код]
Активные металлы[править | править код]
Менее активные металлы и неактивные металлы[править | править код]
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионы окисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
- КАТод — КАТионы (ионы у катода)
- АНод — АНионы (ионы у анода)
Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них постоянного электрического тока наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей:
- при отсутствии ионизатора электролиз проводиться не будет, даже при высоком напряжении;
- электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы;
- уравнения электролиза, как в электролитах, так и в газах, всегда остаются постоянными.
| |||
ru.wikipedia.org
Электролиз | CHEMEGE.RU
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну.
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды.
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы. Положительно заряженный электрод (анод) притягивает отрицательно заряженные частицы (анионы). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины, или графита.
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений:
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал, тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H+.
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный (до Al3+ включительно в ряду напряжений), то вместо металла на катоде восстанавливается (разряжается) водород, т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH—, среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH—
Например, при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al3+ и Н+), то на катоде восстанавливается (разряжается) и металл, и водород, так как потенциал таких металлов сравним с потенциалом водорода:
Men+ + nē → Me0
2H+2O +2ē → H20 + 2OH—
Например, при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe2+ + 2ē → Fe0
2H+2O +2ē → H20 + 2OH—
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов), то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Men+ + nē → Me0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu2+ + 2ē → Cu0
4. Если на катод попадают катионы водорода H+, то они и восстанавливаются до молекулярного водорода:
2H+ + 2ē → H20
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H2O-2).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток, то он окисляется до свободного состояния (до степени окисления 0):
неМеn- – nē = неМе0
Например: при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl— – 2ē = Cl20
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение. Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы:
2H2O-2 – 4ē → O20+ 4H+
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион, то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2O-2 – 4ē → O20 + 4H+
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4O-2H– – 4ē → O20 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например, при электролизе растворов ацетатов выделяется углекислый газ и этан:
2CH3C+3OO– –2ē → 2C+4O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например, электролиз раствора сульфата меди. На катоде восстанавли-ваются ионы меди:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются молекулы воды:
Анод (+): 2H2O-2 – 4ē → O2 + 4H+
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом урав-нении с ионами водорода в виде серной кислоты:
2Cu2+SO4 + 2H2O-2 → 2Cu0 + 2H2SO4 + O20
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются хлорид-ионы:
Анод (+): 2Cl– – 2ē → Cl20
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хло-рида натрия:
2H+2O +2NaCl– → H20 + 2NaOH + Cl20
Следующий пример: электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2O-2 – 4ē → O20 + 4H+
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2H2+O-2 → 2H20 + O20
Еще один пример: электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2Cl– – 2ē → Cl20
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
Cu2+Cl2– → Cu0 + Cl20
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4O-2H– – 4ē → O20 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2H2+O-2 → 2H20 + O20
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na+ + ē → Na0
На аноде окисляются анионы хлора:
Анод (+): 2Cl– – 2ē → Cl20
Сумарное уравнение электролиза расплава хлорида натрия:
2Na+Cl– → 2Na0 + Cl20
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na+ + ē → Na0
На аноде окисляются гидроксид-ионы:
Анод (+): 4OH– – 4ē → O20 + 2H2O
Сумарное уравнение электролиза расплава гидроксида натрия:
4Na+OH– → 4Na0 + O20+ 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например, алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100оС), чем оксид алюминия (2050оС). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
Al2O3 = Al3+ + AlO33-
На катоде восстанавливаются катионы алюминия:
Катод (–): Al3+ + 3ē → Al0
На аноде окисляются алюминат-ионы:
Анод (+): 4AlO33– – 12ē → 2Al2O3 + 3O20
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2Al2О3 = 4Al0 + 3О20
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C0 + О20 = C+4O2-2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например, рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются частицы меди из электрода:
Анод (+): Cu0 – 2ē → Cu2+
Поделиться ссылкой:
chemege.ru
Что такое электролиз? Анод и катод. Физико-химический процесс
Образование 26 июля 2015Долгое время людям не удавалось получать многие чистые вещества в свободном виде. Такие, например, как:
- металлы;
- щелочи;
- хлор;
- водород;
- перекись водорода;
- хлорорганика и прочие.
Их получали либо с большим содержанием примесей, от которых невозможно было избавиться, либо не синтезировали вовсе. А ведь соединения очень важные для использования в промышленности и быту. Но с открытием такого процесса, как электролиз, задача огромного масштаба была решена. Сегодня он применяется не только для синтеза, но и для многих других процессов.
Что такое электролиз? Как он происходит, из каких этапов складывается, в чем заключается основное преимущество данного метода, попробуем разобраться в ходе статьи.
Что такое электролиз?
Чтобы ответить на данный вопрос, следует сначала обратиться к терминологии и уяснить некоторые основные физико-химические понятия.
- Постоянный ток — это направленный поток электронов, исходящий от любого источника электричества.
- Электролит — вещество, раствор которого способен проводить электрический ток.
- Электроды — пластинки из определенных материалов, соединенные между собой, которые пропускают электричество через себя (анод и катод).
- Окислительно-восстановительная реакция — это процесс, при котором происходит изменение степеней окисления участников. То есть одни ионы окисляются и повышают значение степени окисления, другие, напротив, восстанавливаются, понижая ее.
Уяснив все эти термины, можно ответить на вопрос о том, что такое электролиз. Это окислительно-восстановительный процесс, заключающийся в пропускании постоянного тока через раствор электролита и завершающийся выделением разных продуктов на электродах.
Простейшая установка, которую можно назвать электролизером, включает в себя всего несколько компонентов:
- два стакана с электролитом;
- источник тока;
- два электрода, соединенных между собой.
В промышленности использует гораздо более сложные автоматизированные конструкции, позволяющие получать большие массы продуктов — электролизные ванны.
Процесс электролиза достаточно сложный, подчиняется нескольким теоретическим законам и протекает по установленным порядкам и правилам. Чтобы правильно предсказать его исход, необходимо четко усвоить все закономерности и возможные варианты прохождения.
Теоретические основы процесса
Самые главные основополагающие каноны, на которых держится электролиз, — законы Майкла Фарадея — знаменитого ученого-физика, известного своими работами в области изучения электрического тока и всех сопровождающих его процессов.
Всего таких правил два, каждое из которых описывает суть происходящих при электролизе процессов.
Первый закон
Первый закон Фарадея, формула которого записывается как m=kI*Δt, звучит следующим образом.
Масса вещества, выделяющегося на электроде, прямо пропорциональна тому электричеству, которое прошло через электролит.
Из формулы видно, что m — это масса вещества, I — сила тока, Δt — время, в течение которого он пропускался. Также имеется значение k, которое называется электрохимическим эквивалентом соединения. Эта величина зависит от природы самого соединения. Численно k равно массе вещества, которое выделяется на электроде при пропускании через электролит одной единицы электрического заряда.
Второе правило электролиза
Второй закон Фарадея, формула которого — m=M*I*Δt/n*F, звучит следующим образом. Электрохимический эквивалент соединения (k) прямо пропорционален его молярной массе и обратно пропорционален валентности вещества.
Приведенная формула является результатом вывода из всех объединенных. Она отражает суть второго закона электролиза. М — молярная масса соединения, I — сила тока, пропущенного за весь процесс, Δt — время всего электролиза, F — постоянная Фарадея, n — электроны, которые участвовали в процессе. Их число равно заряду иона, принимавшего участие в процессе.
Законы Фарадея помогают понять, что такое электролиз, а также рассчитать возможный выход продукта по массе, спрогнозировать необходимый результат и повлиять на ход процесса. Они и составляют теоретическую основу рассматриваемых преобразований.
Понятие об аноде и его типы
Очень важное значение в электролизе имеют электроды. Весь процесс зависит от материала, из которого они изготовлены, от их специфических свойств и характера. Поэтому рассмотрим более подробно каждый из них.
Анод — плюс, или положительный электрод. То есть такой, который присоединяется к «+» полюсу источника питания. Соответственно, к нему из раствора электролита будут двигаться отрицательные ионы или анионы. Они будут окисляться здесь, приобретая более высокую степень окисления.
Поэтому можно изобразить небольшую схему, которая поможет запомнить анодные процессы: анод «плюс» — анионы — окисление. При этом существует два основных типа данного электрода, в зависимости от которых, будет получаться тот или иной продукт.
- Нерастворимый, или инертный анод. К такому типу относят электрод, который служит лишь для передачи электронов и процессов окисления, однако сам он при этом не расходуется и не растворяется. Таковыми анодами являются изготовленные из графита, иридия, платины, угля и так далее. Используя такие электроды, можно получать металлы в чистом виде, газы (кислород, водород, хлор и так далее).
- Растворимый анод. При окислительных процессах он сам растворяется и влияет на исход всего электролиза. Основные материалы, из которых изготавливаются подобного типа электроды: никель, медь, кадмий, свинец, олово, цинк и прочие. Использование таких анодов необходимо для процессов электрорафинирования металлов, гальванопластике, нанесения защитных покрытий от коррозии и так далее.
Суть всех происходящих процессов на положительном электроде сводится к тому, чтобы разрядились наиболее электроотрицательные по значению потенциала ионы. ИВот почему это делают анионы бескислородных кислот и гидроксид-ион, а потом вода, если речь идет о растворе. Кислородсодержащие анионы в водном растворе электролита вообще на аноде не разряжаются, так как вода делает это быстрее, высвобождая кислород.
Катод и его характеристика
Катод — это отрицательно заряженный электрод (за счет скопления на нем электронов при пропускании электрического тока). Именно поэтому к нему движутся положительно заряженные ионы — катионы, которые претерпевают восстановление, то есть понижают степень окисления.
Здесь для запоминания также уместна схема: катод «минус» — катион — восстановление. В качестве материала для катода могут служить:
- нержавейка;
- медь;
- углерод;
- латунь;
- железо;
- алюминий и прочие.
Именно на этом электроде происходит восстановление металлов до чистых веществ, что является одним из основных способов получения их в промышленности. Также возможен переход электронов от анода к катоду, а если первый — растворимый, то его ионы восстанавливаются на отрицательном электроде. Здесь же происходит восстановление катионов водорода до газа Н2. Поэтому катод — это одна из самых важных частей в общей схеме процесса электролиза веществ.
Электролиз расплавов
С точки зрения химии рассматриваемый процесс имеет свое уравнение. При помощи него можно изобразить всю схему на бумаге и предугадать результат. Самое главное, на что следует обращать внимание, — наличие или отсутствие водной среды и тип анода (растворимый или нет).
Если необходимо получение следующих продуктов: щелочных и щелочноземельных металлов, щелочей, алюминия, бериллия, газы из кислородсодержащих анионов, тогда не может идти речь об электролизе раствора электролита. Только расплав, потому что иначе требуемых соединений не получится. Именно поэтому часто в промышленности синтезируют перечисленные вещества, используя их безводные сухие соли и гидроксиды.
В целом уравнение электролиза расплава выглядит достаточно просто и стандартно. Например, если рассмотреть и записать его для йодида калия, то вид будет следующий:
KI = K+ + I—
Катод (К) «-«: К+ + 1е = К0
Анод (А) «+»: 2I— — 2e = I20
Итог процесса: KI = K + I2.
Точно так же будет записываться электролиз любого металла, независимо от значения его электродного потенциала.
Электролиз водного раствора
Если речь идет о растворах электролитов, то исход процесса будет совсем другой. Ведь вода становится активным участником. Она способна также диссоциировать на ионы и разряжаться у электродов. Поэтому в подобных случаях важное значение имеет электродный потенциал ионов. Чем его отрицательное значение ниже, тем больше вероятность более быстрого окисления или восстановления.
Электролиз водного раствора подчиняется нескольким правилам, которые следует запомнить.
- Анодные процессы: разряжаются только анионы бескислородных кислот (кроме фтороводородной). Если ион кислородсодержащий или фторид-ион, то окисляться будет вода с высвобождением кислорода.
- Катодные процессы: металлы в электрохимическом ряду напряжений (до алюминия включительно) на катоде не восстанавливаются вследствие высокой химической активности. Это делает вода с высвобождением водорода. Металлы от алюминия до водорода восстанавливаются одновременно с водой до простых веществ. Те же, что стоят после водорода в ряду напряжений (малоактивные), легко подвергаются восстановлению до простых веществ.
Если следовать этим правилам, то можно изобразить любой электролиз и просчитать выход продукта. В случае с растворимым анодом схема меняется и становится гораздо более сложной.
Электролиз солей
Данные процессы используют для получения чистых металлов и газов, так как это технологически просто и экономически выгодно. К тому же продукты выходят с большой долей чистоты, что немаловажно.
Например, электролиз меди позволяет быстро получать ее в чистом виде из раствора любой соли. Чаще всего используется медный купорос или сульфат меди (II) — CuSO4.
Как из расплава, так и из раствора данной соли можно извлечь чистый металл, который так необходим практически во всех отраслях электротехники и металлостроительстве.
Значение и применение процесса
Электролиз — очень важный процесс. На его основе базируются такие необходимые технические операции, как:
- Рафинирование металлов.
- Электроэкстракция.
- Гальванотехника.
- Электросинтез.
- Нанесение антикоррозионных покрытий и другие.
monateka.com
