Катод — определение и практическое применение
Это специфическое обозначение часто применяют в описаниях радиотехнических приборов, производственных процессов. Ошибочное понимание терминологии провоцирует аварийные ситуации, увеличивает затраты в ходе монтажных и ремонтных работ. В этой публикации рассказано о том, что такое катод. Примеры с пояснениями помогут правильно решать типовые практические задачи.

Катод и анод – это плюс или минус
Что такое катод
Этим термином обозначают контакт, подключаемый к отрицательной клемме аккумуляторной батареи либо другого источника постоянного тока. На картинке выше – фотографии диода и конденсатора. Эти элементы используют в сетях с переменными электрическими параметрами. Однако и в подобных ситуациях катодным называют подсоединение с учетом соответствующей полярности.
Катод и анод в электрохимии
Соответствующие физические (химические) реакции применяют:
- для создания автономных источников питания;
- при воспроизведении технологических процессов.
В первом случае речь идет об аккумуляторных батареях. Классическая гальваническая пара состоит из двух элементов:
- анода (-), разрушающегося в ходе реакции окисления;
- катода (+), «принимающего» электроны.
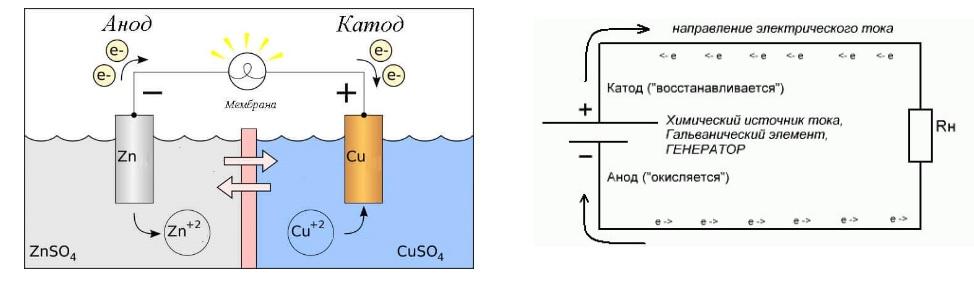
Подключение нагрузки к гальваническому элементу питания
Представленная на рисунке схема поясняет принцип разрушения (восстановления) анода (катода), соответственно. Отмеченный процесс выполняет полезные функции в гальванотехнике. С помощью соответствующих технологий извлекают из растворов ионы металлов и других веществ, создают качественные декоративные и защитные покрытия на изделиях сложной формы.

Зарядка АКБ и электролиз
Как показано на первой схеме, при подключении сильного источника тока в процессе зарядки АКБ катоды и аноды обозначают разные полярности. На второй части рисунка показано, как происходит процесс нанесения медного слоя на деталь. Анод в этой схеме – это электрод, который подключен к «плюсу» батарейки. Он разрушается в процессе электролиза. Ионы меди равномерно накапливаются на катоде, подсоединенном к «минусу». Покрывать благородными и дорогими металлами можно недорогие заготовки из проводящих материалов.
К сведению. Аналогичные методики применяют в химии, чтобы разделить вещества в растворенном состоянии на составные компоненты (ионы).
Катод в вакуумных приборах
Изделия этой категории выполняют свои функции следующим образом. Катод – это генерирующий элемент, который отличается относительно малой работой для выхода электронов. Повышают эффективность данного компонента с помощью нагрева.
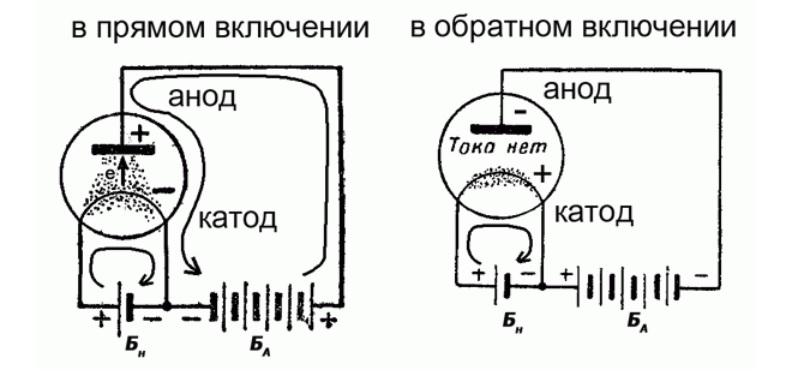
Ток через центральную часть проходит при соответствующей полярности подключения
Эта схема демонстрирует прямую зависимость применяемых терминов от движения электронов. В некоторых вакуумных приборах между анодом и катодом устанавливают сетчатую перегородку, которой регулируют силу тока и соответствующий коэффициент усиления.
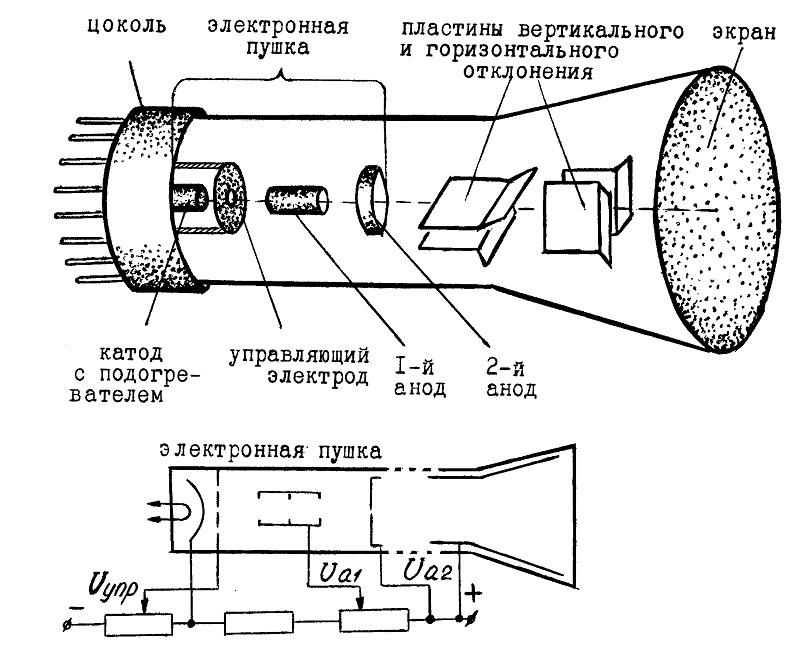
Модифицированный вариант – электронно-лучевая трубка (ЭЛТ)
В типичной конструкции применяют несколько анодов, которые разгоняют электроны и обеспечивают фокусировку луча. Изменением напряжения на горизонтальных (вертикальных) пластинах перемещают поток в нужном направлении. Экран изнутри покрыт слоем люминофора, который светится в видимом диапазоне спектра при попадании заряженных частиц.
Для нагрева применяют прямые и косвенные методики. Катод накрывают модулятором. Это изделие создают в форме стакана с отверстием в центральной части дна. Сюда подают отрицательный потенциал, который оказывает существенное влияние на энергетические параметры пучка и силу свечения.
К сведению. При повышении мощности электронной пушки сфокусированный поток можно использовать для локального нагрева, сварки. Такие технологии обеспечивают высокое качество соединений. В соответствующем исполнении они пригодны для создания оружия.
Катод у полупроводниковых приборов
Изделия этой категории отличаются большим электрическим сопротивлением, по сравнению с проводниками, но меньшим – чем в диэлектриках. Специально подобранная комбинация материалов типового диода (p-n переход) не создает больших препятствий прохождению тока только в одном направлении.
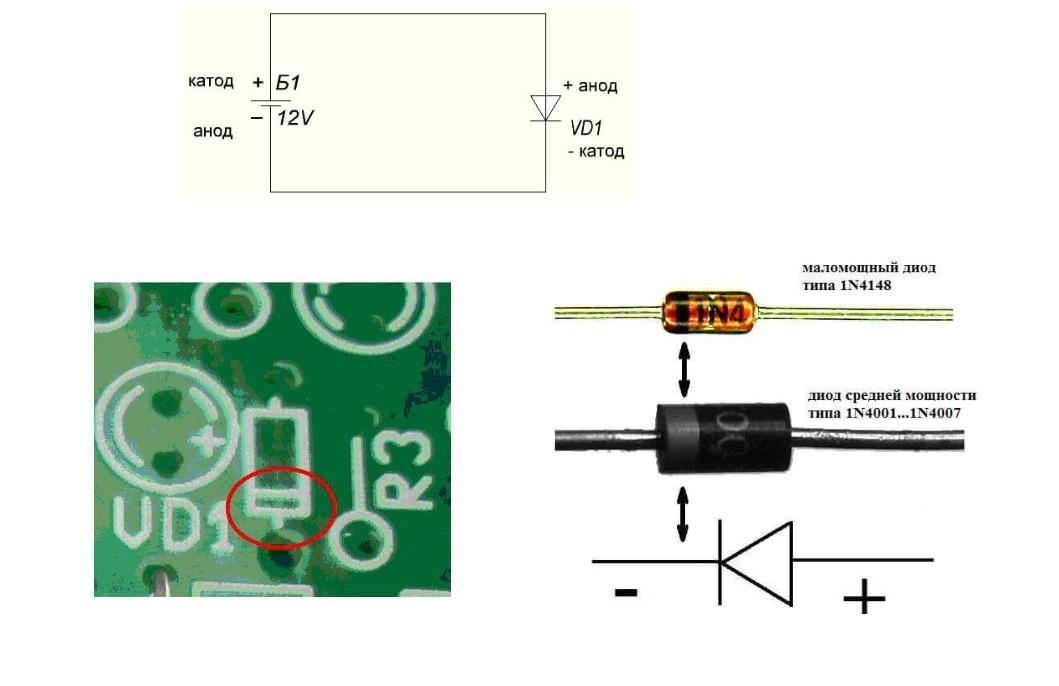
Схема подключения и внешний вид диодов
На верхней части рисунка показаны обозначения источника питания постоянного тока и полупроводникового прибора. По стандартным рисункам на плате и утолщенным линиям несложно определить соответствующий вывод. Прозрачный корпус миниатюрных моделей не препятствует визуальной идентификации. Правильные выводы можно сделать при внимательном изучении светодиодов. Более крупная часть в том и другом примере – это катод.
Тиристор создан по аналогии с ламповыми аналогами. С помощью третьего электрода управляют работой электронного ключа.
Знак катода
Ошибки в применении понятий возникают по причине разных подходов. Химики рассматривают процессы окисления и восстановления (анод – это «плюс», а катод – «минус»). Соответствующее подключение внешнего источника питания активизирует движение ионов и отдельные химические реакции.
В гальванических элементах наблюдаются обратные процессы. Избыточное количество электронов на одном из функциональных компонентов обеспечивает окисление цинкового или другого электрода. В этом примере при подключении нагрузки восстанавливается второй элемент (катод) – это контакт батареи, обозначенный знаком «плюс».
Как показано выше, ситуация изменяется при подключении внешнего более сильного источника питания. От направления движения тока меняются соответствующие обозначения ламповых приборов.
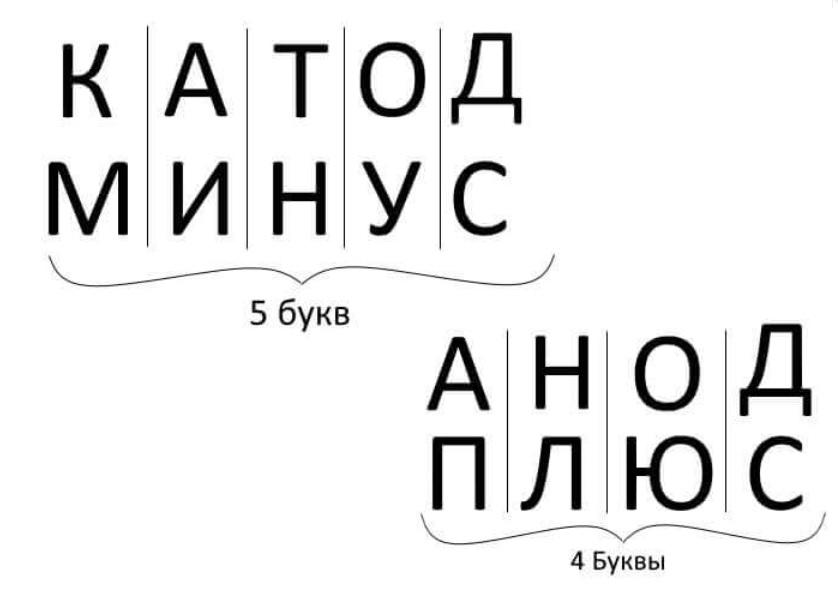
Как определить анод – это плюс или минус
Представленное на последнем рисунке правило действительно при рассмотрении электротехнических схем, полупроводниковых приборов. Для уточнения полярности достаточно проверить соответствие количества букв.
Видео
Катоды и аноды отрицательно и положительно заряженные электроды
Катод – это электрод устройства, который подключен к отрицательному полюсу источнику тока. Анод – противоположность ему. Это электрод прибора, подключенный к положительному полюсу источника тока.

Окислительно-восстановительный процесс на электродах
Обратите внимание! Чтобы легче запомнить разницу между ними, используют шпаргалку. В словах «катод»-«минус», «анод»-«плюс» одинаковое число букв.
Применение в электрохимии
В этом разделе химии катод – это отрицательно заряженный электрический проводник (электрод), притягивающий к себе положительно заряженные ионы (катионы) во время процессов окисления и восстановления.
Электролитическое рафинирование – это электролиз сплавов и водных растворов. Большинство цветных металлов подвергаются такой очистке. При помощи электролитической очистки получается металл с высокой чистотой. Так, степень чистоты меди после рафинирования достигает 99,99%.

Электролиз меди
На положительном электрическом проводнике во время рафинирования или очистки проходит электролитический процесс. Во время него металл с примесями помещают в электролизер и делают анодом. Такие процессы проводятся при помощи внешнего источника электрической энергии и называются реакциями электролиза. Осуществляются в электролизерах. Он выполняет функцию электронасоса, нагнетающего отрицательно заряженные частицы (электроны) в отрицательный проводник и удаляющего его из анода. Откуда исходит ток, неважно.
На катоде очищается металл от посторонних примесей. Простой катод изготавливается из вольфрама, иногда – из тантала. Достоинством вольфрамового отрицательного электрода является стойкость его изготовления. Из недостатков – имеет низкую эффективность и неэкономичность. Сложные катоды имеют разное устройство. У многих таких типов проводников на чистый металл сверху наносится специальный слой, который активирует получение большей производительности при относительно низких температурах. Они очень экономичны. Их недостаток состоит в небольшой устойчивости производительности.
Готовый чистый металл тоже называется катодом. Например, цинковый или платиновый катод. На производстве отрицательный проводник отделяют от катодной основы при помощи катодосдирочных машин.
При удалении отрицательно заряженных частиц из электрического проводника на нем создается анод, а при нагнетании отрицательно заряженных частиц на электрический проводник – катод. При электролизе очищаемого металла его положительные ионы притягивают к себе отрицательно заряженные частицы на отрицательном проводнике, и происходит восстановительный процесс. Чаще всего используют такие аноды:
- цинковые;
- кадмиевые;
- медные;
- никелевые;
- оловянные;
- золотые;
- серебряные;
- платиновые.
Чаще всего на производстве используют цинковые аноды. Они бывают:
- катанные;
- литые;
- сферические.
Больше всего применяют катанные цинковые аноды. Еще используют никелевые и медные. А вот кадмиевые почти не используются из-за их токсичности для экологии. Бронзовые и оловянные аноды применяют при изготовлении радиоэлектронных печатных плат.
Гальванизация (гальваностегия) – процесс нанесения тонкого слоя металла на другой предмет с целью предотвращения коррозии изделия, окисления контактов в электронике, износостойкости, декорации. Суть процесса такая же, как при рафинировании.
Цинк и олово используют для повышения стойкости изделия при коррозии. Цинкование бывает холодным, горячим, гальваническим, газотермическим и термодиффузионным. Золото используют в основном в защитно-декоративных целях. Серебро повышает стойкость контактов электроприборов к окислению. Хром – для увеличения износостойкости и защиты от коррозии. Хромирование придает изделиям красивый и дорогой вид. Используется для нанесения на ручки, краны, колесные диски и т.д. Процесс хромирования токсичен, поэтому строго регламентируется законодательством разных стран. Ниже на картинке представлен метод гальванизации при помощи никеля.

Никелирование чайника методом гальванизации
Применение в вакуумных электронных приборах
Здесь катод выступает источником свободных электродов. Они образуются в ходе их выбивания из металла при высоких температурах. Положительно заряженный электрод притягивает электроны, выпущенные отрицательным проводником. В разных аппаратах он в разной степени собирает их в себя. В электронных трубках он полностью притягивает отрицательно заряженные частицы, а в электронно-лучевых приборах – частично, формируя в завершении процесса электронный луч.
Маркировка
Стандартно катод маркируют как «-». Знак анода – «+». А вот в гальванике, из-за того, что отрицательный заряд на проводнике снабжается не источником тока извне, а реакцией окисления металла, катод получит положительный заряд электрического проводника. Поэтому в аккумуляторах, когда ток меняет направление, происходит смена знаков «+» и «-».
Эти свойства катодов и анодов нашли широкое применение в промышленности при очистке металла и в гальваностегии.
Видео
Оцените статью:Катод и анод — это плюс или минус?
Изучение таких отраслей, как электрохимия и цветная металлургия, невозможно без понимания в полной мере терминов катод и анод. В то же время эти термины являются неотъемлемой частью вакуумных и полупроводниковых электронных приборов.

Вакуумные и полупроводниковые компоненты
Катод и анод в электрохимии
Под электрохимией следует понимать раздел физической химии, изучающий химические процессы, вызываемые воздействием электрического тока, а также электрические явления, вызываемые химическими процессами. Существует два основных вида электрохимических операций:
- Процедура преобразования электрического воздействия в химическую реакцию, называемая электролизом;
- Процедура преобразования химической реакции в электрический ток, называемая гальваническим процессом.

Гальванический элемент в электрохимии
В электрохимии под терминами анод и катод понимают следующее:
- Электрод, на котором проходит окислительная реакция, называется анодом;
- Электрод, на котором осуществляется процедура восстановления, называется катодом.
Под процессами окисления стоит понимать процедуру, при которой частица отдает электроны. Восстановительный процесс подразумевает процедуру принятия электронов частицей. Соответственно, частицы, которые отдают электроны, именуются «восстановителями», и они подвержены окислению. Частицы, которые принимают электроны, именуются «окислителями», они восстанавливаются.
Цветная металлургия широко использует процесс электролиза для выделения металлов из добытых руд и дальнейшей очистки. В процедуре электролиза применяются растворимые и нерастворимые аноды, а сами процессы называются электрорафинированием и электроэкстракцией, соответственно.
Катод в вакуумных приборах
Одной из разновидностей электровакуумных приборов является электронная лампа. Предназначение электроламп – регулирование потока электронов, дрейфующих в вакууме между другими электродами. Конструктивно электролампа выглядит как герметичный сосуд-баллон, с помещенными в середине мелкими металлическими выводами. Численность выводов зависит от вида радиолампы.
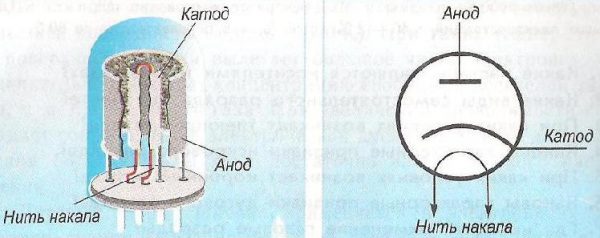
Устройство электронной лампы
В составе любой радиолампы такие элементы:
- Катод;
- Анод;
- Сетка.
Катодом электролампы подразумевается разогретый электрод, подключенный к «минусу» блока питания и испускающий электроны, будучи накаленным. Эти электроны движутся к аноду, подключенному к «плюсу». Процесс испускания электронов разогретым катодом называется термоэмиссией, а возникший при этом ток именуется током термоэмиссии. Метод нагрева обуславливает разновидности катодов:
- Катод прямого разогрева;
- Катод непрямого разогрева.
Катодом непосредственного накала является прочный вольфрамовый проводник большого сопротивления. Прогревание катода проходит путем подвода к нему напряжения.
Важно! К особенностям электронных ламп непосредственного нагрева относятся быстрый запуск лампы в работу при меньшем потреблении мощности, хотя за счет срока службы. Поскольку питающий ток таких ламп является постоянным, то ограничено их применение в среде переменного тока.
Электролампы, у которых внутри катода, выполненного в виде цилиндра, размещена нагревающая нить, называются радиолампами косвенного нагрева.
Конструктивно анод выглядит в виде пластины либо коробочки, размещенной вокруг катода с сеткой и имеющей потенциал, обратный катоду. Дополнительные электроды, размещенные между анодом и катодом, называются сеткой и применяются для регулировки потока электронов.
Катод у полупроводниковых приборов
К полупроводниковым приборам относятся устройства, состоящие из вещества, удельное электрическое сопротивление которого больше сопротивления проводника, но меньше сопротивления диэлектрика. К особенностям таких приборов относится большая зависимость электропроводимости от концентрации добавок и влияния электрическим током. Свойства p-n перехода определяют принципы работы большей части полупроводниковых компонентов.
Наиболее простым представителем полупроводниковых компонентов является диод. Это элемент, имеющий два вывода и один p-n переход, отличительной особенностью которого выступает протекание тока в одном направлении.

Диод полупроводниковый
Отводы компонента называются анод и катод. Протекание тока по элементу возможно при подключении «плюса» к аноду и «минуса» – к катоду. При противоположном подсоединении элемент запирается, и ток не протекает.
Такие словосочетания, как анод и катод, в полной мере применяются в приборостроении и индустрии, будь то электрохимия, вакуумные приборы или полупроводниковые приборы. Усвоение многих процессов затруднительно или невозможно без понимания терминов анод и катод.
Видео
Оцените статью:Анод — Википедия. Что такое Анод




Ано́д (др.-греч. ἄνοδος — движение вверх) — электрод некоторого прибора, присоединённый к положительному полюсу источника питания. Электрический потенциал анода положителен по отношению к потенциалу катода (кроме гальванических элементов).[источник не указан 1317 дней]
Анод в электрохимии
При процессах электролиза (получение элементов из солевых растворов и расплавов под действием постоянного электрического тока), анод — электрически положительный полюс, на нём происходят окислительно-восстановительные реакции (окисление), результатом которых, в определённых условиях, может быть разрушение (растворение) анода, что используется, к примеру, при электрорафинировании металлов.
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде. Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Кроме принудительной организации полезных электрохимических процессов, аноды применяются и для защиты от последствий нежелательных, побочных электрохимических процессов.
Анод в вакуумных электронных приборах
В вакуумных электронных приборах анод — электрод, который притягивает к себе летящие электроны, испущенные катодом. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
Анод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключённый к положительному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют анодом, подключённый к отрицательному полюсу — катодом.Знак анода и катода
В литературе встречается различное обозначение знака анода — «+» или «−», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление[1]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод.
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора[2][3].
В электротехнике анод — положительный электрод, ток течёт от анода к катоду, электроны, соответственно, наоборот.
См. также
Литература
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
Основные понятия по гальваническим покрытиям
Главная → Основные понятия по гальваническим покрытиям
Анод (в гальванотехнике) – положительный электрод, на котором происходит процесс окисления (отдачи электронов). Анод может быть растворимым и нерастворимым (инертным). Растворимый анод выполняется из металла или сплава, который должен быть осажден. Нерастворимый анод может выполняться, например, из углерода, свинца, титана, и т.д. в зависимости от условий электролиза. Инертный анод не растворяется в процессе осаждения покрытий, на нем происходят побочные реакции, например, выделение газообразного кислорода.
Выпрямитель – основное оборудование гальванического цеха – устройство преобразования переменного тока промышленной частоты в постоянный. Выпрямитель, при определенном исполнении, может изменять постоянный ток по заданной программе, делать его реверсивным, импульсным и т.д.
Выход по току – доля тока, расходуемая на протекание основной реакции – осаждения металла или сплава.
Гальваническая ванна – емкость, содержащая электролит, электроды на штангах, дополнительные элементы, например, бортовые отсосы, теплоизоляцию, нагреватели, диафрагмы, барботеры (устройства для прокачки воздуха через раствор) и т.д. Гальваническая ванна может быть выполнена из металла или полимера (полиэтилен, полипропилен, тефлон и т.д.) В ванне, как правило, находится химически стойкий футеровочный материал, отделяющий корпус ванны от электролита (винипласт, пластикат, фторопласт и т.д.).
Гальванические покрытия – покрытия, полученные восстановлением ионов металлов из электролита под действием электрического тока.
Гальванопластика – область гальванотехники, занимающаяся получением толстых металлических покрытий на изделиях-формах с целью их копирования. Гальванопластикой можно получать как копии металлических предметов, так и неметаллических (диэлектричеких).
Гальваностегия – область гальванотехники, занимающаяся преимущественно нанесением защитных, защитно-декоративных и специальных металлических покрытий на изделия. Следует отметить, что сегодня к гальваностегии относятся и такие процессы как анодирование (оксидирование) и химическое осаждение металлов и сплавов.
Гальванотехника (гальваника) – отрасль электрохимии, занимающаяся нанесением металлических покрытий на изделия с использованием электрохимических реакций. Покрытие образуется путем восстановления ионов (принятия ими электронов) осаждаемого металла из электролита при пропускании через него тока.
Катод – в гальванотехнике — отрицательный электрод, на котором происходит восстановление (принятие электронов) ионов осаждаемого металла и образование покрытия. Катод – это непосредственно покрываемые изделия (кроме процесса анодирования).
Оксидирование – получение оксидных покрытий на металлических изделиях, в основном из стали, алюминия, титана. Оксидирование может быть выполнено электрохимически (на аноде под током — анодирование), химически (в растворе без тока), термически (например, воронение стали на воздухе под действие высокой температуры).
Отходы – нецелевые продукты, образованные в ходе производства за счет несовершенства технологии, которые невозможно более использовать в данном техпроцессе.
Катодная плотность тока – отношение тока, протекающего через электролизер к площади катода.
Себестоимость покрытия – себестоимость покрытия складывается из затрат на все технологические операции плюс затраты на электроэнергию, воду, переработку стоков, заработную плату персонала и другие, менее затратные статьи. Нанесение покрытия – процесс достаточно сложный и дорогостоящий, учитывая, что под каждый вид покрытия требуется отдельная технологическая линия, состоящая иногда из двадцати ванн, включая промывочные.
Технологические операции – основными технологическими операциями в гальваностегии являются: механическая подготовка, обезжиривание, травление, декапирование, электролиз, сушка. Дополнительно могут быть проведены и другие операции – отжиг, пассивация и т.д. Между операциями проводится промывка. Первые четыре операции – подготовка поверхности, т.е. удаление с нее механических, органических, оксидных загрязнений. При этом травлением удаляются толстые оксидные слои, а декапированием (активированием) – тонкие, непосредственно перед электролизом (нанесением покрытия). Электролиз при химическом нанесении покрытия заменяется на безтоковое осаждение из специального раствора, содержащего соль металла, восстановитель и добавки.
Электрод (в гальванотехнике) – твердый электропроводный элемент электрохимической системы, на который подается внешнее напряжение от выпрямителя. Электроды делятся на катоды и аноды.
Электролит – раствор, проводящий электрический ток за счет ионной проводимости. В гальванике электролит – раствор, из которого осаждаются металлические и неметаллические покрытия. Электролит в гальванотехнике содержит соль осаждаемого металла (кроме электролитов анодирования и хромирования) и добавки – буферные (для регулирования водородного показателя — рН), блескообразующие, фоновые (для увеличения электропроводности раствора).
Электрохимия – область химии, а точнее, физической химии, занимающаяся изучением процессов на границе электрод/электролит, в том числе при прохождении через нее тока от внешнего источника.
Данная
статья является интеллектуальной собственностью ООО «НПП Электрохимия»
Любое копирование без прямой ссылки на сайт www.zctc.ru преследуется по
закону. Текст статьи обработан сервисом Яндекс «Оригинальные тексты»
Гальванический анод — Википедия
Материал из Википедии — свободной энциклопедии
 Пример гальванического анода на корпусе корабля.
Пример гальванического анода на корпусе корабля.Гальванический анод является основным компонентом системы гальванической катодной защиты, используемой для защиты подземных или подводных металлических конструкций от коррозии .
Они сделаны из металлического сплава с более «активным» напряжением (больший отрицательный восстановительный потенциал / больший положительный электрохимический потенциал ), чем металл структуры. Разница в потенциале между двумя металлами означает, что гальванический анод корродирует, так что материал анода расходуется в большей степени, чем конструкция.
Потеря материала анода приводит к появлению альтернативного названия жертвенного анода .
Вкратце, коррозия — это химическая реакция, происходящая по электрохимическому механизму ( окислительно-восстановительная реакция ). [1] Во время коррозии происходят две реакции: окисление (уравнение Шаблон:EquationNote ), когда электроны покидают металл (и приводит к фактической потере металла), и восстановление, где электроны используются для превращения воды или кислорода в гидроксиды (уравнения Шаблон:EquationNote и Шаблон:EquationNote ). [2]Шаблон:NumBlkШаблон:NumBlkШаблон:NumBlk В большинстве сред гидроксид-ионы и ионы двухвалентного железа образуют гидроксид двухвалентного железа , который в конечном итоге становится хорошо знакомой коричневой ржавчиной: [3]Шаблон:NumBlk Когда происходит коррозия, происходят реакции окисления и восстановления, и на поверхности металла образуются электрохимические элементы, так что некоторые области становятся анодными (окисление), а некоторые — катодными (восстановление). Электроны текут из анодных областей в электролит по мере коррозии металла. И наоборот, когда электроны текут из электролита в катодные зоны, скорость коррозии уменьшается. [4] (Поток электронов находится в направлении, противоположном потоку электрического тока ).
По мере того как металл продолжает корродировать, локальные потенциалы на поверхности металла будут меняться, а анодная и катодная области будут меняться и двигаться. В результате в черных металлах по всей поверхности образуется общее покрытие из ржавчины, которое в конечном итоге будет поглощать весь металл. Это скорее упрощенный взгляд на процесс коррозии, потому что он может происходить в нескольких различных формах. [5]
Катодная защита работает, вводя другой металл (гальванический анод) с гораздо более анодной поверхностью, так что весь ток будет течь от введенного анода, и металл, который должен быть защищен, станет катодным по сравнению с анодом. Это эффективно останавливает реакции окисления на поверхности металла, передавая их на гальванический анод, который будет принесен в жертву в пользу защищаемой конструкции. [6]
Чтобы это работало, между анодом и защищаемым металлом (например, проволокой или прямым контактом) должен быть путь электронов, а также путь ионов между окислителем (например, водой или влажной почвой) и анодом, и между окислителем и металлом, подлежащему защите, таким образом образуя замкнутый контур; поэтому простое приклеивание части активного металла, такого как цинк, к менее активному металлу, такому как мягкая сталь, в воздухе (плохой проводник и, следовательно, отсутствие замкнутой цепи) не обеспечит никакой защиты.
В качестве гальванических анодов используются три основных металла: магний, алюминий и цинк. Все они доступны в форме блоков, прутов, листов или штампованной ленты. Каждый материал имеет свои преимущества и недостатки.
- ↑ Shrier 10:4
- ↑ Peabody p.2
- ↑ Shrier 3:4
- ↑ Peabody p.21
- ↑ Shrier 1:2
- ↑ Shrier 10:29
Обсуждение:Анод — Википедия
Материал из Википедии — свободной энциклопедии
Народ добавьте категорию В химии-> физическая химия-> «Электрохимия» Как вообще добавить категорию???
- Поместить категорию в другую так же просто как статью в категорию — просто пишешь [[Category:Физическая химия]] на странице редактирования категории Category:Электрохимия. MaxiMaxiMax 14:02, 21 Мар 2005 (UTC)
При наборе в яндексе слова «анод» на первом месте выдается страничка следующего содержания: Анод — Википедия Ано́д — (др.-греч. ἄνοδος — движение вверх) отрицательный полюс источника тока ( гальванического элемента, электрической батареи и т. д.) или электрод некоторого прибора, присоединённый к отрицательному полюсу источника питания. ru.wikipedia.org›Анод копия ещё Александр62.165.37.210 07:06, 18 мая 2010 (UTC)
по поводу самого определения[править код]
Автор, пожалуйста обратите внимание, возможно я чего-то упустил, но если нет- это повод для скорейшей правки:
В ссылках приводится замечательная статья «Знаем ли мы, что такое АНОД?» http://electrik.info/main/fakty/99-znaem-li-my-chto-takoe-anod.html и тут же определение ей радостно противоречит:
автор статьи всю дорогу объясняет что термин А. необходимо определять со стороны электрохимии и направление движения заряда в текущем режиме (как в источнике оно меняется в зависимости от заряда/разряда так и в электролизе), и в частности приводит ГОСТ «ГОСТ 15596-82. ИСТОЧНИКИ ТОКА ХИМИЧЕСКИЕ. Термины и определения». Там на странице 3 можно прочесть следующее: «Отрицательный электрод химического источника тока это электрод, который при разряде источника является анодом».
и тут же в статье видим
Ано́д — (др.-греч. ἄνοδος — движение вверх) положительный полюс источника тока ( гальванического элемента, электрической батареи и т. д.) или электрод некоторого прибора, присоединённый к положительному полюсу источника питания.
что конечно правильно, но лишь для двух частных случаев и как-то вообще оставляет без внимания электрохимию и направление движения заряда.
Понимаю что эта область вообще полна условностей в направлениях и определениях, тем тщательне́е™ к ним надо, я считаю
В электротехнике анод — положительный электрод, ток течет от анода к катоду, электроны, соответственно, наоборот.[править код]
Последнее предложение статьи:»В электротехнике анод — положительный электрод, ток течет от анода к катоду, электроны, соответственно, наоборот.» Давно так не смеялся. —188.134.32.37 16:14, 23 января 2013 (UTC)
- А что смешного? Всё правильно написано. Принято (в физике, электротехнике, схемотехнике), что направление движения электрического тока — это направление движения положительных зарядов, которые движутся в направлении отрицательного градиента потенциала (от «+» к «-»). Поэтому и графическое изображение диода представляет собой «стрелку», показывающую направление тока от анода(+) к катоду(-). И в графическом изображении транзистора — «стрелка» эмитера показывает протекание тока через него от плюса к минусу. А реально, электроны движутся от минуса к плюсу (например, в электровакуумных приборах — испускаются отрицательным катодом и притягиваются положительным анодом). Zatvornik 18:53, 23 января 2013 (UTC)
Прошу прощения. Невнимательно прочитал и как следствие ерунду написал. Если можно удалите тему.
—188.134.32.37 15:25, 25 января 2013 (UTC)
Возможно, необходимо внести пояснение:
Как правило анод, внутри гальванического элемента, соединен с отрицательным выводом, который в свою очередь приходится отрицательным катодом для внешней цепи.
194.247.25.37 12:10, 1 ноября 2015 (UTC)
Именно так («электрод некоторого прибора, присоединённый к полюсу источника питания«)? То же и про Катод. А как же тогда все аноды и катоды источников тока, в частности гальванических элементов и аккумуляторов? Одних только статей про их разновидности несколько десятков наберется только в википедии… Или даже аноды-катоды люминисцентных ламп, к примеру, которые питаются от сети переменного тока?
Автор сообщения: 37.113.156.53 16:47, 2 ноября 2017 (UTC)
- Вопросы, конечно, интересные. Но они не для страницы «Сообщения об ошибках», а скорее для письма в редакцию журнала «Хочу всё знать». Или хотя бы для страницы Обсуждение:Анод. —37.190.0.166 19:13, 2 ноября 2017 (UTC)
- Катод упустили. Раз такое противоречие — может по данному вопросу сей журнал не АИ или надо брать несколько источников? 37.113.180.123 19:40, 2 ноября 2017 (UTC)
- Если считать гальванический элемент прибором (а что мешает?), то
 Не ошибка. Пояснения в тексте есть. А вот высокоумная фраза «Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии» реально доставляет. —KVK2005 (обс.) 19:31, 2 ноября 2017 (UTC)
Не ошибка. Пояснения в тексте есть. А вот высокоумная фраза «Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии» реально доставляет. —KVK2005 (обс.) 19:31, 2 ноября 2017 (UTC)- Всё бы ничего, если бы не «присоединённый к полюсу источника питания«, т.е. когда гальванический элемент не присоединён к источнику питания (? зачем и к какому источнику питания) у него нет ни катода, ни анода? Явно ошибка. Во вторых формулировка: там пишется «присоединённый к положительному (для анода)/отрицательному (для катода) полюсу источника питания, для чего я и привёл в качестве примера Люминесцентная лампа — они работают от переменного тока, но катод-анод у них не меняется с частотой 50 Гц (в принципе в статье описаны в разделе ЭВП, но как-то надо определение подкорректировать — а то получается, что это не статья, а дизамбиг, но при этом оформлена как статья). 37.113.180.123 19:49, 2 ноября 2017 (UTC)
- Предложите всеобъемлющую формулировку не чрезмерного размера. —KVK2005 (обс.) 20:08, 2 ноября 2017 (UTC)
- Зачем изобретать велосипед? Хотя бы тот же викисловарь: уже отпадают непонятки с источниками тока, а в БСЭ обобщённо «положительный электрод источника тока и электроды с ним соединённые, но полнее всего тут электрод> электронного или электротехнического прибора (например, электронной лампы, гальванического элемента, электролитической ванны>), характеризующийся тем, что движение электронов во внешней цепи направлено от него (к катоду) — чётко, ясно, кратко и недвусмысленно, охватывает все аспекты (ну ионы можно наверное ещё добавить (катионы, анионы) для полного счастья). 37.113.180.123 21:36, 2 ноября 2017 (UTC)
- Да, пожалуй, разделить на пункты (как в БСЭ) будет правильнее всего. Последнее определение строго, но требует известного умственного напряжения для осознания. —KVK2005 (обс.) 12:37, 3 ноября 2017 (UTC)
 К обсуждению —Well-Informed Optimist (?•!) 11:13, 2 декабря 2017 (UTC)
К обсуждению —Well-Informed Optimist (?•!) 11:13, 2 декабря 2017 (UTC)

 Не ошибка. Пояснения в тексте есть. А вот высокоумная фраза «Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии» реально доставляет. —KVK2005 (обс.) 19:31, 2 ноября 2017 (UTC)
Не ошибка. Пояснения в тексте есть. А вот высокоумная фраза «Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии» реально доставляет. —KVK2005 (обс.) 19:31, 2 ноября 2017 (UTC) К обсуждению —Well-Informed Optimist (?•!) 11:13, 2 декабря 2017 (UTC)
К обсуждению —Well-Informed Optimist (?•!) 11:13, 2 декабря 2017 (UTC)