Как определить где катод где анод. Катод и анод в теории и практике. Применение в электрохимии
Автор больше всего боится, что неискушённый читатель далее заголовка читать не станет. Он считает, что определение терминов анод и катод известно каждому грамотному человеку, который, разгадывая кроссворд, на вопрос о наименовании положительного электрода сразу пишет слово анод и по клеточкам всё сходится. Но не так много можно найти вещей страшнее полузнания.
Недавно в поисковой системе Google в разделе «Вопросы и ответы» я нашел даже правило, с помощью которого его авторы предлагают запомнить определение электродов. Вот оно:
«Катод — отрицательный электрод, анод — положительный . А запомнить это проще всего, если посчитать буквы в словах. В катоде столько же букв, сколько в слове «минус», а в аноде соответственно столько же, сколько в термине «плюс».
Правило простое, запоминаемое, надо было бы его предложить школьникам, если бы оно было правильным. Хотя стремление педагогов вложить знания в головы учащихся с помощью мнемоники (наука о запоминании) весьма похвально. Но вернемся к нашим электродам.
Для начала возьмем очень серьезный документ, который является ЗАКОНОМ для науки, техники и, конечно, школы. Это «ГОСТ 15596-82 . ИСТОЧНИКИ ТОКА ХИМИЧЕСКИЕ. Термины и определения ». Там на странице 3 можно прочесть следующее: «Отрицательный электрод химического источника тока это электрод, который при разряде источника является анодом ». То же самое, «Положительный электрод химического источника тока это электрод, который при разряде источника является катодом ». (Термины выделены мной. БХ). Но тексты правила и ГОСТа противоречат друг-другу. В чем же дело?
А всё дело в том, что, например, деталь, опущенная в электролит для никелирования или для электрохимического полирования, может быть и анодом и катодом в зависимости от того наносится на нее другой слой металла или, наоборот, снимается.
Электрический аккумулятор является классическим примером возобновляемого химического источника электрического тока. Он может быть в двух режимах — зарядки и разрядки. Направление электрического тока в этих разных случаях будет в самом аккумуляторе прямо противоположным , хотя полярность электродов не меняется .
В зависимости от этого назначение электродов будет разным. При зарядке положительный электрод будет принимать электрический ток, а отрицательный отпускать. При разрядке — наоборот. При отсутствии движения электрического тока разговоры об аноде и катоде бессмысленны .
«Поэтому, во избежание неясности и неопределенности, а также ради большей точности, — записал в своих исследованиях М.Фарадей в январе 1834г., — я в дальнейшем предполагаю применять термины, определение которых сейчас дам».
Каковы же причины введения новых терминов в науку Фарадеем?
А вот они: «Поверхности, у которых, согласно обычной терминологии, электрический ток входит в вещество и из него выходит, являются весьма важными местами действия и их
В те времена после открытия Т. Зеебеком явления термоэлектричества имела хождение гипотеза о том, что магнетизм Земли обусловлен разностью температур полюсов и экватора, вследствие чего возникают токи вдоль экватора. Она не подтвердилась, но послужила Фарадею в качестве «естественного указателя » при создании новых терминов. Магнетизм Земли имеет такую полярность, как если бы электрический ток шел вдоль экватора по направлению кажущегося движения солнца.
Фарадей записывает: «На основании этого представления мы предлагаем назвать ту поверхность, которая направлена на восток — анодом, а ту, которая направлена на запад — катодом». В основе новых терминов лежал древнегреческий язык и в переводе они значили: анод — путь (солнца) вверх, катод — путь (солнца) вниз.
В русском языке есть прекрасные термины ВОСХОД и ЗАХОД, которые легко применить для данного случая, но почему-то переводчики Фарадея этого не сделали. Мы же рекомендуем пользоваться ими, ибо в них корнем слова я
Задача n 157
Составьте схему гальванического элемента, напишите электронные уравнения электродных процессов и суммарное уравнение соответствующей окислительно-восстановительной реакции. Вычислите концентрацию раствора электролита или ЭДС.
Номер задачи | Ме-талл 1-го элек-трода | Электролит 1-го электрода | Концентрация электролита 1-го электрода, моль/л | Ме-талл 2-го элек-трода | Электролит 2-го электрода | Концентрация электролита 2-го электрода, моль/л | ЭДС, В |
157 | Hg | HgCl2 | 0,01 | Al | AlCl3 | 1,00 | ? |
Решение
Гальванический элемент — это электрохимическая система, в которой энергия окислительно-восстановительной реакции трансформируется в электрическую энергию, т.е. такая система служит в качестве химического источника тока.
Анодный процесс заключается в окислении металла, характеризующегося более отрицательной величиной электродного потенциала Е0, в катодном процессе участвует частица-окислитель, присутствующая в катодном электролите.
Для металлов, приведенных в условии задачи:
Электрод | |
Al3+, Аl | -1,662 |
Нg2+, Нg | +0,854 |
Более отрицательной величиной электродного потенциала характеризуется металл Аl, поэтому именно он и будет участником анодного процесса.
Металл анода окисляется, что можно представить в виде электронного уравнения вида:
Ме0 — m e— = Mem+
Для данного металла:
Аl 0 — 3 e— = Аl 3+
Катодный процесс заключается в восстановлении катионов металла, входящих в состав соли – электролита катода.
Соответствующее электронное уравнение имеет вид:
Men+ + n e— = Me0
Для системы, описанной в условии задачи:
Нg2+ + 2e— = Нg 0
Электрохимическая схема — это условная запись, в которой представлена информация о аноде и катоде с указанием металлов, состава электролитов, а также особенностях конструкции данногогальванического элемента:
Металл I | Электролит I || Электролит II | Металл II
(с более .. (с менее
отриц.Е0) отриц.Е0)
Анод катод
Для рассматриваемого в задаче гальванического элемента электрохимическая схема имеет вид:
Аl | AlCl3 || HgCl2| Нg
а н о д к а т о д
Чтобы вычислить ЭДС гальванического элемента, необходимо найти разность потенциалов катода и анода:
ЭДС = Е катода — Е анода
где Е0 – стандартный электродный потенциал металла анода или катода, n — число электронов, отдаваемых восстановителем или принимаемых окислителем, С — концентрация электролита, моль/л.
Следовательно, ЭДС гальванического элемента может быть представлена следующей формулой:
ЭДС = (Емет. катода + lg Cэл-та катода) – (Емет. анода + lgCэл-та анода)
Подставляем численные данные условия задачи и производим необходимые вычисления:
Емет. катода = 0.854 В
Cэл-та катода = 1 моль/л
lg C эл-та катода = 0
n =2 для катодного процесса)
Емет. анода = -1.662 В
Cэл-та анода = 0.01 моль/л
lgCэл-та анода = …….….
n = 3(для анодного процесса)
ЭДС = (0.854+ 0) – (-1.662 + -2)
ЭДС = 2.549
Поиск по сайту |
|
Анод — ОКСИ Про
Анод – это электрод прибора, который присоединяется к положительному полюсу необходимого источника питания. При этом электрический потенциал анода является положительным по отношению к потенциалу указанного катода. Во всех процессах электролиза анод – это электрически положительный полюс, на котором происходят окислительно-восстановительные реакции. Получается, что результатом этих операций может быть разрушение анода. Это используется, например, при электрорафинировании металлов.
Самые популярные аноды
В металлургии используется анод для гальваники для того, чтобы наносить на поверхность изделий слой металла электрохимическим способом или для электрорафинирования. При этом процессе металл с примесями полностью растворяется на аноде, а потом осаждается в чистом виде на катоде.
В основном распространены аноды из цинка, которые могут быть литыми, сферическими, катаными. Причем последние используются чаще всего. Кроме того, берут аноды из никеля, меди, олова, бронзы, кадмия, сплава сурьмы и свинца, серебра, платины и золота. А вот из кадмия аноды почти не используют, что обуславливается их экологической вредностью. Анод из драгоценных металлов используют для того, чтобы повысить коррозионную стойкость, улучшить эстетические свойства предметов, а также для других целей. Кроме того, они пригодятся и для того, чтобы повысить электропроводность изделий.
В вакуумных электронных приборах анод – это специальный электрод, который способен притягивать к себе любые летящие электроны, которые испущены катодом. В рентгеновских трубках и электронных лампах он имеет такую конструкцию, когда полностью поглощает все электроны. В электронно-лучевых трубках аноды являются элементами электронной пушки, которые поглощают только часть летящих электронов, формируя при этом электронный луч после себя. В полупроводниковых приборах электроды, которые подключаются к положительному источнику тока, когда прибор открыт, то есть он имеет небольшое сопротивление, называют анодом, а тот, что подключен к отрицательному полюсу, соответственно, – катодом.
Знак анода и катода
В специальной литературе часто можно встретить самое разное обозначение знака анода: «+» или «-». Это определяется особенностями рассматриваемых процессов. К примеру, в электрохимии считают, что катод – это электрод, на котором протекает процесс восстановления, а анод – это электрод, на котором протекает процесс окисления. При активной работе электролизера внешний источник тока обеспечивает на одном электроде избыток электронов и здесь происходит восстановление металла. Этот электрод является катодом. А на другом электроде, в свою очередь, обеспечивается недостаток электронов и происходит окисление металла, и его называют анодом.
При работе гальванического элемента, на одном из электродов избыток электронов обеспечивается уже не внешним источником тока, а именно реакцией окисления металла, то есть здесь отрицательным будет уже анод. Электроны, которые проходят через внешнюю цепь, будут расходоваться на протекание реакции восстановления, то есть катодом можно назвать положительный электрод.
Исходя из такого толкования, для аккумулятора аноды и катоды меняются местами в зависимости от того, как направлен ток внутри аккумулятора. В электротехнике анодом называют положительный электрод. Так электрический ток течет от анода к катоду, а электроны – наоборот.
Катод – Уикипедия

Катод (от гръцки κάθοδος (kathodos) – спускане, много надолу) е отрицателният полюс на източник на постоянен ток, или електродът на прибор, присъединен към отрицателния полюс на източника на ток.[1] Идеята за името е на Майкъл Фарадей.[2]Потенциалът на катода при работа на източника или този електрод в схемите с електронни прибори, винаги е по-нисък от потенциала на другия електрод с името анод.
От създателите на теорията и законите в електротехниката за движение на електрическия ток е приета посоката на движение на положителните заряди. Тези закони, обосновката и приложението им се използват и до днес. Исторически това се е наложило поради факта, че електроните като основни токоносители с отрицателна полярност са открити значително по-късно. На това се дължи „конфликтът“ – приетата теоретична посока на тока в една електрическа верига е обратна на посоката на движение на електроните като физически носители и създатели на този поток от наелектризирани частици.[3]
 Галваничен елемент на Даниел-Якоби. Електроните, създаващи отрицателния заряд, се обезпечават не от външен източник на ток, а от собствената реакция при окисление на цинка и от електроните, протичащи през външната верига, възстановяващи медни атоми върху катода (електродът е обозначен като „+“)
Галваничен елемент на Даниел-Якоби. Електроните, създаващи отрицателния заряд, се обезпечават не от външен източник на ток, а от собствената реакция при окисление на цинка и от електроните, протичащи през външната верига, възстановяващи медни атоми върху катода (електродът е обозначен като „+“) 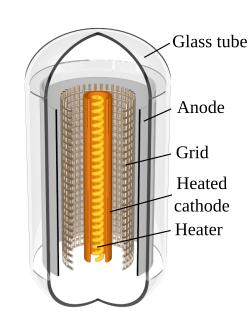 Схема на напречен разрез на триод с конструктивното разположение на електродите му. Катодът конструктивно обхваща отоплението на прибора, за да емитира мощен поток електрони
Схема на напречен разрез на триод с конструктивното разположение на електродите му. Катодът конструктивно обхваща отоплението на прибора, за да емитира мощен поток електрониАнгличанинът Джон Фредерик Даниел (1790 – 1845) конструира електрохимичен елемент мед-цинк, включва двата елемента, потопени съответно в меден сулфат и сярна киселина. Понастоящем този галваничен източник на електрически ток е известен с името Даниел-Якоби, с което се отразява и приносът на руския учен Якоби. При разглеждане на електрохимичните процеси, протичащи в галваничните елементи, се ползва химическа терминология, която внася различия с приетите понятия за положителен и отрицателен полюс на галванични източници на електрически ток:
- Електродът, на който протича окисление, се нарича анод. На анода йони на цинка преминават в електролита, а освободените им електрони остават на повърхността на цинковия електрод, като създават отрицателен потенциал. По тази причина поставения в електролита цинков електрод се разрушава. Потокът от неговите освободени електрони по проводника и консуматора създават електрическия ток в електрическата верига. Анодът е отрицателният извод на този галваничен елемент.
- Електродът, на който протича редукция, се нарича катод. На катода от мед медните йони получават чрез електрическата верига по два електрона и медта от медения сулфат (син камък) се редуцира в медни атоми, които се натрупват върху катода. Катодът е положителният извод на галваничния елемент. Чрез този електрохимичен процес придвижването на токоносители – електрони през свързващия проводник и включеният в него консуматор от анода към катода, е протичане на електрически ток.[4]
Това свойство намира приложение в електрохимията за електролитно рафиниране на метали. При електролиза на мед, никел и др. метали върху електрода – катод, се отлага очистен от примеси метал.
Катод във вакуумните електронни прибори[редактиране | редактиране на кода]
Във електронните прибори, работещи във вакуумна среда, катодът е електрод включен към най-ниския (отрицателен) потенциал за дадената електронна схема. Той е източник на свободни електрони в прибора в резултат на термоелектронната емисия, предизвикана от неговата отрицателната полярност и загряването му от отоплителната намотка. Конструктивно това се прави като в катодният електрод като цилиндър се вмества отоплителната намотка. Катодът като източник на електронен поток се използва и в електронно-лъчевите прибори като съществен елемент на т.нар. електронна пушка.
Катодът на полупроводниковите прибори[редактиране | редактиране на кода]
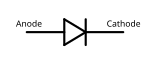 Схемно обозначаване на диод
Схемно обозначаване на диод 
Катодът на полупроводниковите прибори е електродът на диодите и тиристорите, свързан с отрицателния полюс на източника на ток. На това се основава и основната функция на тези прибори – да имат малко съпротивление и да пропускат електрически ток само при такава полярност. Положителният полюс на източника на ток се свързва към анода на прибора. При обратна полярност, приложена на електродите, тези полупроводникови прибори имат много голямо съпротивление и практически не са проводими за електрически ток за схемата, в която са включени.
- ↑ Ал. Милев, Б. Николов, Й. Братков. Речник на чуждите думи в българския език, Издателство „Наука и изкуство“, Четвърто преработено и допълнено издание, София, 1978, стр. 331
- ↑ Еленков, Николай. Многоликата фея на електричеството … или за електрохимията по-популярно, Издател „Образователни технологии“, София, 1999, стр. 38, ISBN 954-9889-02-5
- ↑ Сарман, Жан-Пиер. Енциклопедичен речник по физика, Превод от френски и съставителство проф. Петко Девенски, Издателство Мартилен, София, 1995, стр. 127 ISBN 954-598-041-9
- ↑ Еленков, Николай. Многоликата фея на електричеството … или за електрохимията по-популярно, Издател „Образователни технологии“, София, 1999, стр. 26 ISBN 954-9889-02-5
Ответы@Mail.Ru: про катод и анод
Катод отдает электроны — остаютя, + заряженные частицы, Анод принимает электроны, следовательно, на нем избыток отрицательного заряда, то есть — .
Движение электронов от анода к катоду. Да подсоединяют Анод+,Катод-
я те вот тут ответил как есть: <a rel=»nofollow» href=»http://otvet.mail.ru/question/24302061/» target=»_blank» >http://otvet.mail.ru/question/24302061/</a>
Чисто по физике — всё правильно. Ну вот нравится Химикам, что любая пластина, опущенная в электролит — АНОД. Отсюда и непонятки…
Из каких материалов сделаны катод и анод?
Зависит от того, где они находятся. В электролизной ванне — это одно, в радиолампе — совсем другое. Например, в радиолампах катод делается из тугоплавкого металла и покрывается слоем оксида редкоземельных металлов с низкой работой выхода. А в мощных лампах усилителей теле и радиопередатчиков анод делают из графита. В автомобильном аккумуляторе анод и катод сделаны из свинца. Намёк понятен?
из любого проводника не обязательно металл
Из любого проводника, минус-будит катод, плюс- будит анод.
Смотря где, катод и анод это общее название электродов, они могут быть и в электронных лампах ( обычно сплавы с использованием тугоплавких металлов никель молибден вольфрам и тд) , и в электролизных ваннах ( там могут использоваться и угольные электроды).
И катод и анод-металлические, вот материаллы различные. В радиолампах-одно, в сварочном-другое, в дуговых прожекторах-третье и т. д.
При такой формулировке вопроса — нет однозначного ответа. Другое дело, если, похоже, вопрос касается материалов, из которых изготавливаются анод и катод электровакуумных приборов — ламп (диод, триод, тетрод и т. д. ) Тут от материала зависит надежность и долговечность прибора, это таки-да важно. Для этого случая: Простейший катод электронной лампы представляет собой нить (или тонкую узкую ленточку) из тугоплавкого материала (например вольфрама) . Нить может быть прямой или изогнутой в виде буквы Л или М; встречаются нити и с большим числом изгибов. Через нить-катод пропускается электрический ток, который нагревает его. Из вылетевших с поверхности катода электронов вокруг катода образуется «электронное облачко» , которое носит название пространственного заряда. Поверхности катодов большинства электронных ламп покрываются окислами (оксидами) щелочноземельных металлов (бария, стронция и кальция) . Такие катоды носят название оксидных. Оксидные покрытия повышают эффективность излучения электронов с поверхности катода. <img src=»//otvet.imgsmail.ru/download/9442a5f7783c1b2fa15a37f7df607273_i-42.jpg» > Рис. Устройство катодов. а — простейший катод прямого накала; б — катод прямого накала зигзагообразной формы (1 — крепежные стойки; 2 — нить накала; 3 — амортизационные пружины; 4 — слюдяной или керамический изолятор) ; в — подогревный катод (1 — металлическая трубочка; 2 — жароупорное покрытие; 3 — нить накала; 4 — оксидный слой) . Слово анод означает электрод, имеющий положительный заряд. Когда напряжение на нем положительно по отношению к катоду, анод притягивает к себе электроны. Он имеет вид цилиндра, окружающего катод, или другую форму . Изготавливается анод из тугоплавкого металла. <img src=»//otvet.imgsmail.ru/download/9442a5f7783c1b2fa15a37f7df607273_i-43.jpg» > Рис. Аноды и сетки а — цилиндрический анод; б — плоский анод; в, г — сетки для ламп с цилиндрическими анодами; д, е — сетки для ламп с плоскими анодами. В зависимости от типа и назначения лампы аноды выполняются из углеродистой стали, вольфрама, графит (ГУ-81). Кстати, эта лампа, в отличие от более современных, практически «вечная» — «спалить» ее можно, только очень постаравшись. Катод прямого накала из вольфрама, анод графитовый. http*://*radiobooka.*ru/*lampov_teh/196-osnovnye-chasti-yelektronnoj-lampy.html (убрать звездочки)
Какие металлы используются для улавливания ионов водорода и гидроксилов?
